Enfermedad actual
Mujer de 59 años, exfumadora con un índice acumulado de 40 paquetes-año, con hipertensión arterial controlada con antihipertensivo e hiperplasia nodular focal hepática. Además, fue intervenida en 2008 de histerectomía y doble anexectomía por un cistoadenoma mucinoso de ovario. Niega antecedentes familiares oncológicos y alergias medicamentosas.
Exploración física
En febrero de 2017 comienza con tos seca que progresivamente se acompaña de disnea y de síndrome general, por lo que finalmente acude a su médico de atención primaria en abril de 2017. Presenta ECOG 1, con auscultación cardiopulmonar normal.
Pruebas diagnósticas
En abril de 2017 se realiza radiografía de tórax que manifiesta una masa hiliar izquierda de 7 × 5 cm con pérdida de volumen en lóbulo superior izquierdo (LSI), por lo que se completa estudio con tomografía computarizada (TC) corporal, en la que se observa la obstrucción del bronquio del LSI conocida con adenopatías subcarinales e hiliares bilaterales, múltiples adenopatías abdominales, una masa suprarrenal derecha de 3 cm y otra renal derecha de 4 cm.
Posteriormente, se realiza broncoscopia en la que se observa infiltración de mucosa sospechosa, con biopsia compatible con células de adenocarcinoma positivo para TTF1 y negativo p40. Además, se realiza biopsia de la masa renal, confirmándose su origen metastásico pulmonar. Se realiza estudio molecular, con ligando 1 de muerte programada (PD-L1) 90% y EGFR, ALK y ROS1 negativos.
Con esto, se presenta en comité multidisciplinario y se remite a oncología médica para inicio de tratamiento sistémico.
Diagnóstico
Adenocarcinoma pulmonar de LSI estadio IV por afectación ganglionar, suprarrenal y renal (mayo-17), PD-L1 90% alto expresor, EGFR, ALK y ROS1 negativos.
Tratamiento
En junio de 2017 es valorada en consultas de oncología médica y, al tratarse de una paciente alta expresora de PD-L1, se inicia pembrolizumab a dosis de 200 mg cada 3 semanas, con base en los resultados del estudio KEYNOTE-024. Este estudio demostró beneficio en supervivencia libre de progresión y supervivencia global con buen perfil de toxicidad al usar pembrolizumab durante 2 años en comparación con quimioterapia basada en platino en pacientes con carcinoma pulmonar no microcítico avanzado no tratados con PD-L1 mayor del 50%.
A partir del tercer ciclo de pembrolizumab presenta franca mejoría clínica, con excelente tolerancia al tratamiento y objetivándose respuesta parcial a todos los niveles en primer TC corporal de control en septiembre de 2017. Como incidencias, en noviembre de 2017 se documenta hipotirodismo inmunomediado, por lo que se inicia tratamiento sustitutivo y continúa con la inmunoterapia. Continúa tratamiento con pembrolizumab con controles por imagen periódicos que constatan respuesta parcial mantenida hasta junio de 2019, cuando, tras cumplir dos años de tratamiento, se suspende la inmunoterapia y pasa a seguimiento (Fig. 1).
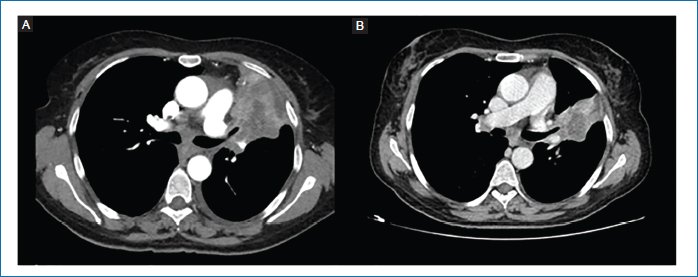
Figura 1. Tomografía computarizada corporal diagnóstico (abril de 2017) (A) y en respuesta parcial (septiembre de 2017) (B) (imágenes cedidas por la autora).
Evolución y seguimiento
Mantiene controles clínicos y radiológicos hasta que en mayo de 2020 comienza con disnea de esfuerzo y astenia, y se documenta mediante TC corporal y tomografía por emisión de positrones-tc con 18 fluorodesoxiglucosa progresión a nivel pulmonar con crecimiento de la masa izquierda con atelectasia distal de 4,3 × 3,3 cm y alcance de la rama superior de la arteria pulmonar izquierda, junto a crecimiento de una adenopatía paraesofágica izquierda.
Teniendo en cuenta el intervalo libre de progresión desde la suspensión del pembrolizumab, se decide iniciar tratamiento sistémico y realizar una maniobra local paliativa, logrando suspender dicho tratamiento con respuesta parcial mantenida de la enfermedad tras 3 años (Fig. 2).
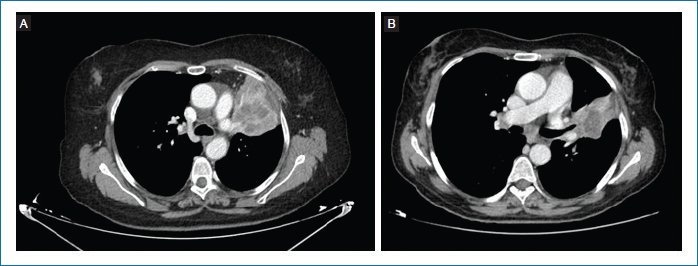
Figura 2. Tomografía computarizada corporal con progresión pulmonar (mayo de 2020) (A) y en respuesta parcial mantenida (enero de 2025) (B) (imágenes cedidas por la autora).
Financiación
La autora no ha recibido financiación para la elaboración de este caso clínico.
Conflicto de intereses
La autora declara no tener conflicto de intereses relevantes.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki. Los procedimientos fueron autorizados por el Comité de Ética de la institución.
Confidencialidad, consentimiento informado y aprobación ética. Los autores han seguido los protocolos de confidencialidad de su institución, han obtenido el consentimiento informado de los pacientes, y cuentan con la aprobación del Comité de Ética. Se han seguido las recomendaciones de las guías SAGER, según la naturaleza del estudio.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.