Enfermedad actual
Varón de 64 años que ingresa en neumología en abril de 2024 por disnea de esfuerzo progresiva desde hace 6 meses junto a disfonía y pérdida de 7 kg de peso en los últimos tres meses.
Tratamiento actual
Enalapril 20 mg al día, simvastatina 20 mg al día, escitalopram 10 mg al día.
Antecedentes e historia clínica
Varón de 64 años fumador de 100 paquetes-año y diagnóstico previo de dislipidemia, hipertensión arterial, EPOC y depresión.
Exploración física
El paciente se encontraba eupneico, saturando al 94% con oxígeno. Murmullo vesicular abolido en el hemitórax izquierdo. Resto anodino.
Exploraciones complementarias
Radiografía de tórax (4 de abril de 2024): se observó una opacidad blanca en el pulmón izquierdo (Fig. 1A).
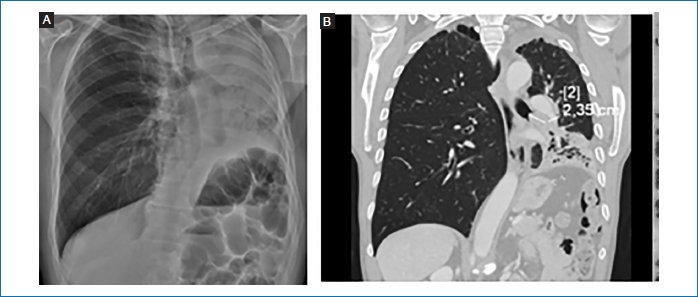
Figura 1. A: placa de tórax. B: tomografía computarizada de tórax realizada al diagnóstico (26/04/2024) (imágenes cedidas por el autor).
Pruebas diagnósticas
En la tomografía computarizada (TC) del 30/04/2024 se observa una imagen endoluminal en pulmón izquierdo de 23 mm que conlleva una atelectasia del hemitórax izquierdo (Fig. 1B).
Se realiza el 03/05/2024 una fibrobroncoscopia en la que se objetiva parálisis de cuerda vocal izquierda y una masa de la que toman biopsias con resultado de carcinoma escamoso de pulmón, ligando 1 de muerte programada del 30%. No se realizó análisis molecular (secuenciación de nueva generación), ya que en nuestro centro solo se realiza a la progresión.
En la PET del 10/05/2024, nódulo hipermetabólico hiliar izquierdo con un SUVmáx de 11,2 con atelectasia global del pulmón izquierdo (Fig. 2).
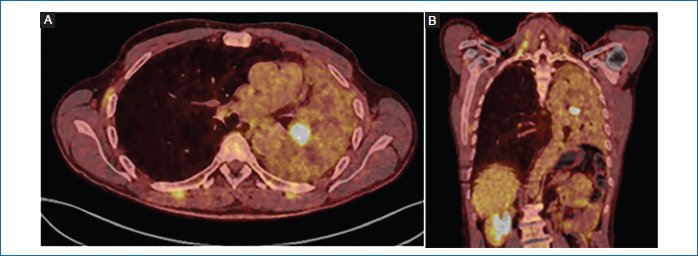
Figura 2. A y B: tomografía por emisión de positrones al diagnóstico 10/05/2024 (imágenes cedidas por el autor).
Diagnóstico
Carcinoma escamoso izquierdo T4N0M0, estadio IIIA por afectación del nervio recurrente.
Tratamiento
La ecobroncoscopia (EBUS) confirmó N0, decidimos realizar tratamiento neoadyuvante con carboplatino, paclitaxel y pembrolizumab. Tras dos ciclos, mostró respuesta metabólica completa (RPC) en la tomografía por emisión de positrones (PET) (Fig. 3)1–4.
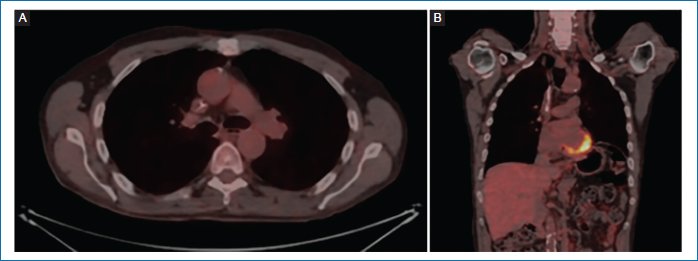
Figura 3. A y B: tomografía por emisión de positrones de valoración de respuesta 25/07/2024 (imágenes cedidas por el autor).
Evolución y seguimiento
Dada la buena respuesta presentada, la cirugía posterior consistiría en neumonectomía izquierda. Los datos de los últimos estudios con inmunoterapia neoadyuvante hacen replantearnos la práctica clínica habitual que hasta ahora conocemos1–4. La tasa de RPC es un marcador predictivo de muy buen pronóstico1–4. Con la quimioterapia hasta ahora obteníamos una tasa de RPC que no llegaba al 5%. Con la llegada de la inmunoterapia a este escenario, esta tasa se ve multiplicada por 51,2. Nuestro paciente se hizo una nueva EBUS con biopsias que fueron negativas para malignidad. A pesar de ello, la única forma de comprobar la RPC es la intervención. Nuestro paciente presentaba una «neumonectomía funcional» por atelectasia completa del pulmón al diagnóstico con necesidad de oxigenoterapia con pruebas funcionales patológicas, por lo que explicamos la situación al paciente y decidió no intervenirse. Para esto la radioterapia no aportaría beneficios adicionales claros y no hay evidencia, por lo que optamos por continuar con inmunoterapia. A día de hoy, el paciente continúa sin necesidad de oxigenoterapia y con PET que continúan en RPC.
Financiación
La autora no ha recibido financiación para la elaboración de este caso clínico.
Conflicto de intereses
La autora declara no tener conflicto de intereses relevantes.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki. Los procedimientos fueron autorizados por el Comité de Ética de la institución.
Confidencialidad, consentimiento informado y aprobación ética. Los autores han seguido los protocolos de confidencialidad de su institución, han obtenido el consentimiento informado de los pacientes, y cuentan con la aprobación del Comité de Ética. Se han seguido las recomendaciones de las guías SAGER, según la naturaleza del estudio.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.