Antecedentes
- – Exfumador de dos paquetes/día desde los 13 hasta los 50 años, con DA de 74 paquetes/año.
- – Hipertensión arterial en tratamiento con enalapril 10 mg/24 h y dislipidemia en tratamiento con simvastatina 20 mg/24 h.
- – Neumonía unilobar por coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2) en diciembre de 2021, sin necesidad de ingreso hospitalario.
- – Trombocitosis esencial sin tratamiento, en seguimiento por el servicio de hematología.
Exploración física
En el momento del diagnóstico, el paciente se encontraba asintomático a nivel neurológico y sin alteraciones en el resto de la exploración física. ECOG-PS 0.
Enfermedad actual
Durante el seguimiento del infiltrado pulmonar por SARS-CoV-2, se aprecia una lesión en lóbulo superior derecho (LSD), sugestiva de un tumor primario pulmonar.
Exploraciones complementarias al diagnóstico
- – Tomografía computarizada (TC) torácica 12/02/2021: masa pulmonar apical derecha, sin adenopatías (Fig. 1A).
- – BAG 21/02/2021: fragmentos de material necrótico, insuficiente para diagnóstico.
- – Tomografía por emisión de positrones-tomografía computarizada (PET-TC) cuerpo entero con 18F-FDG 02/03/2021: masa pulmonar apical derecha de 51 × 51 × 52 mm (SUVmáx 10) con centro necrótico, compatible con proceso neoformativo pulmonar (Fig. 1B). La lesión infiltra la superficie pleural mediastínica, sin poder descartar afectación de la ácigos. Sin adenopatías ni otras lesiones patológicas a distancia.
- – Ecobroncoscopia 07/04/2021: adenocarcinoma.
- – Resonancia magnética (RM) cerebral 16/04/2021: pequeña lesión única parietal izquierda (5 mm), compatible con M1.
- – Biopsia líquida (Foundation Medicine): BCORL1 M644fs*20, mutación S768I en el exón 20 de EGFR.
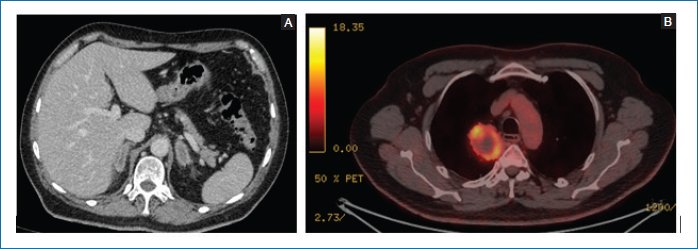
Figura 1. A: tomografía por emisión de positrones-tomografía computarizada con 18 fluorodesoxiglucosa del 02/03/2021 que muestra la lesión tumoral primaria en lóbulo superior derecho. B: tomografía computarizada del 15/02/2021 que muestra el crecimiento de la lesión suprarrenal izquierda y la aparición de una lesión suprarrenal derecha (imágenes cedidas por el autor).
Diagnóstico
Adenocarcinoma de pulmón en LSD, cT3N0M1b por oligometástasis parietal izquierda única, con mutación S768I en exón 20 de EGFR.
Tratamientos, exploraciones complementarias y evolución
- Quimioterapia (QT) basada en CDDP-vinorelbina concomitante a la radioterapia (60 Gy a 2 Gy/fx) → mayo de 2021-julio de 2021.
- – PET-TC 13/09/2021: oligoprogresión suprar- renal.
- – RM cerebral 16/09/2021: respuesta radiológica de la lesión parietal izquierda.
- Afatinib1–3 → septiembre de 2021-diciembre de 2021.
- – TC 15/12/2021: progresión de la lesión adrenal izquierda nueva M1 adrenal derecha.
- – Rebiopsia de la lesión adrenal izquierda 03/01/2022, NGS (TSO500): carga mutacional tumoral (TMB) 38.8 mut/Mb y mutación EGFR S768I (sin T790M).
- QT con CBDCA-pemetrexed → marzo de 2022-noviembre de 2022 (mantenimiento con pemetrexed de junio a noviembre).
- – TC 13/11/2022: progresión suprarrenal.
- – Rebiopsia de la metástasis adrenal izquierda 12/12/2022, NGS (TSO500): TMB 35.4 mut/Mb y mutación EGFR S768I (sin T790M).
- Inmunoterapia con nivolumab → enero de 2023-febrero de 2025.
- – TC 31/05/2023: respuesta casi completa pulmonar, suprarrenal y cerebral (lesiones milimétricas).
- – PET-TC 26/02/2025: respuesta morfometabólica casi completa (Figura 2).
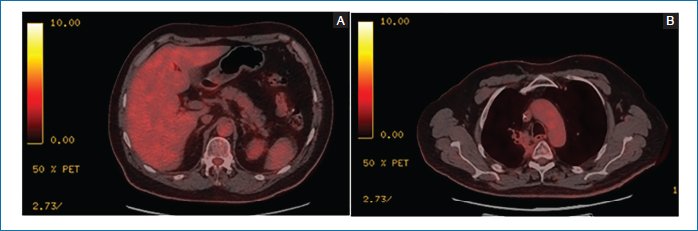
Figura 2. Tomografía por emisión de positrones-tomografía computarizada con 18 fluorodesoxiglucosa del 26/02/2025 que muestra una respuesta morfometabólica completa suprarrenal bilateral (A) y una casi completa pulmonar (B) (imágenes cedidas por el autor).
Financiación
El autor declara que no ha recibido financiación específica por parte de agencias del sector público, sector comercial o entidades sin ánimo de lucro para la realización de este trabajo.
Conflicto de intereses
El autor declara no tener ningún conflicto de intereses relacionado con los contenidos de este trabajo.
Consideraciones éticas
Protección de personas y animales. El autor declara que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. Los autores han seguido los protocolos de confidencialidad de su institución, han obtenido el consentimiento informado de los pacientes, y cuentan con la aprobación del Comité de Ética. Se han seguido las recomendaciones de las guías SAGER, según la naturaleza del estudio.
Declaración sobre el uso de inteligencia artificial. El autor declara que no utilizó ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.