Enfermedad actual
Varón de 71 años con carcinoma escamoso de pulmón en lóbulo superior izquierdo T2 (40 mm) N2 (ganglionar única en ventana aortopulmonar) M0, estadio IIIA, ligando 1 de muerte programada (PD-L1) 95%.
Tratamiento actual
Actualmente en tratamiento con metformina 850 mg cada 24 h, olmesartán 40 mg cada 24 h, simvastatina 20 mg cada 24 h, omeprazol 20 mg cada 24 h y Spiolto© Respimat© 2.5/2.5 mcg 2 inhalaciones cada 24 h.
Antecedentes e historia clínica
Varón de 71 años con hipertensión arterial, diabetes mellitus tipo 2, dislipidemia, EPOC moderada en tratamiento broncodilatador y suprarrenalectomía por adenoma funcionante y síndrome de Cushing secundario en 2023 como antecedentes médicos de interés. Exfumador desde hace 9 años (índice paquetes año 45) y bebedor moderado de alcohol en el momento del diagnóstico. Sin antecedentes familiares de interés.
Comienza estudio en el servicio de neumología por cuadro de tos persistente e infección respiratoria que motiva la realización de pruebas complementarias.
Exploración física
- – ECOG 1. Consciente, orientado y colaborador. Eupneico en reposo. Normohidratado y perfundido.
- – Auscultación cardiaca: tonos rítmicos, sin soplos audibles.
- – Auscultación pulmonar: murmullo vesicular conservado, sin ruidos sobreañadidos.
- – Abdomen: blando, depresible, no doloroso a la palpación. Ruidos hidroaéreos conservados. No se palpan masas ni megalias. Sin signos de irritación peritoneal.
- – Miembros inferiores: no presenta edema ni signos de trombosis venosa profunda.
Exploraciones complementarias
- – Tomografía computarizada (TC) de tórax (01/07/2024): masa sólida en segmento anterior del lóbulo superior izquierdo (LSI) de 35 mm, en íntimo contacto con la pleura visceral, sugestivo de neoplasia. Adenopatía en ventana aortopulmonar izquierda compatible con metástasis.
- – TC craneal (19/07/2024): sin evidencia de afectación metastásica.
- – BAG lesión pulmonar en LSI (19/07/2024).
- – Anatomía patológica (23/07/2024): carcinoma epidermoide poco diferenciado. PD-L1 95%.
- – Tomografía por emisión de positrones-tomografía computarizada basal (07/08/2024): masa pulmonar en segmento anterior del LSI (40 mm, SUVmáx 15.12), en contacto con la pleura, en relación con neoplasia. Adenopatía hipermetabólica en ventana aortopulmonar (SUVmáx 7.9) compatible con metástasis.
Diagnóstico
Carcinoma escamoso de pulmón en LSI T2 (40 mm) N2 (ganglionar única en ventana aortopulmonar) M0, estadio IIIA, PD-L1 95%.
Tratamiento
Inicia tratamiento neoadyuvante con carboplatino- taxol-nivolumab durante 4 ciclos (1.er ciclo 26/08/2024, 4.º ciclo 28/10/2024) según estudio CHECKMATE 8161 en situación de respuesta parcial vs. completa morfometabólica tras el 4.º ciclo (octubre de 2024). Se decide derivación al servicio de cirugía torácica para planificación quirúrgica (Figura 1).
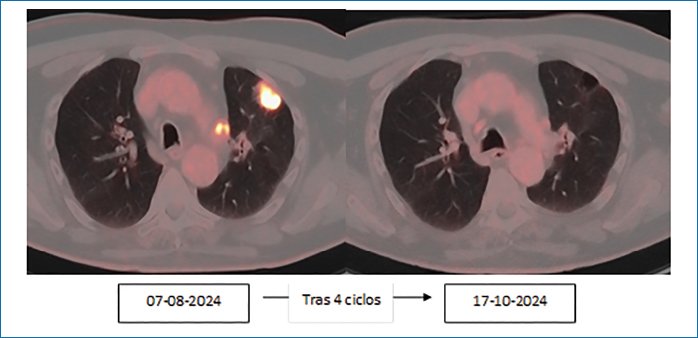
Figura 1. Tratamiento neoadyuvante con carboplatino-taxol-nivolumab durante 4 ciclos.
Evolución y seguimiento
Acude a consulta tras realización de lobectomía superior izquierda y linfadenectomía mediastínica R0 el día 10 de diciembre de 2024 con resultado ypT0 ypN2 (1/11 mic [subaórtico izquierdo]).
En pieza quirúrgica se observa un lecho tumoral de 3,5 × 2 cm, con respuesta patológica completa y 0% de tumor residual viable. También se extraen cuatro ganglios con la pieza, uno de ellos con signos de respuesta a QT. Se realiza linfadenectomía de seis áreas, obteniendo un total de siete ganglios, dos de ellos con signos de respuesta parcial a QT y uno (región 5) con afectación milimétrica tumoral (2 mm).
Por tanto, nos encontramos ante un paciente con excelente respuesta a tratamiento neoadyuvante, pero con enfermedad mínima residual ganglionar (2 mm en adenopatía subaórtica). En esta situación, con base en el estudio CHECKMATE 8161, procedemos a iniciar seguimiento.
Sin embargo, con base en resultados de estudios posteriores en el ámbito perioperatorio como CHECKMATE 77T con nivolumab2, KEYNOTE 671 con pembrolizumab y3 AEGEAN con durvalumab4, se plantea la discusión de si, en este caso, el paciente se podría beneficiar del tratamiento neoadyuvante, dado el resultado anatomopatológico posquirúrgico.
Financiación
La realización del presente caso clínico no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de intereses
El autor declara no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki. Los procedimientos fueron autorizados por el Comité de Ética de la institución.
Confidencialidad, consentimiento informado y aprobación ética. Los autores han seguido los protocolos de confidencialidad de su institución, han obtenido el consentimiento informado de los pacientes, y cuentan con la aprobación del Comité de Ética. Se han seguido las recomendaciones de las guías SAGER, según la naturaleza del estudio.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.